
Am 12. Januar 2023 wurde eine bahnbrechende Studie veröffentlicht, die die Art und Weise, wie wir über das Altern denken, verändert. Wenn du glaubst, dass Altern ein unvermeidlicher evolutionärer Prozess ist und der Titel dieser Seite schamloser Clickbait ist, könnte die Zusammenfassung dieser neuen Veröffentlichung deine Sichtweise ändern.
Diese bahnbrechende Veröffentlichung ist das Ergebnis verschiedener Experimente, die in den letzten zehn Jahren durchgeführt wurden. Sie stellt einen wichtigen Meilenstein dar, der die Art und Weise verändert, wie Wissenschaftlerinnen und Wissenschaftler Studien zur Alternsforschung konzipieren werden, und kann auch bei der Entwicklung eines einheitlichen Ansatzes zur Behandlung altersbedingter Krankheiten helfen.
Zusammenfassung
Die Autorinnen und Autoren dieses Papiers haben die wichtigsten Ergebnisse dieser relativ komplexen Publikation mit einer gut ausgearbeiteten, anschaulichen Metapher umrissen:
- Das Genom der Säugetiere kann als unsere biologische Hardware betrachtet werden.
- Das Epigenom kann man sich als unsere Software vorstellen. Es wirkt sich nicht auf die Hardware aus, sondern beeinflusst vielmehr die Art und Weise, wie wir unsere Hardware nutzen.
- Bis jetzt dachten wir, dass ein Zusammenbruch der Hardware (d.h. DNA-Schäden) die Hauptursache für das Altern ist.
- Die Ergebnisse der Experimente in dieser Studie legen das Gegenteil nahe. Die Software scheint den biologischen Alterungsprozess voranzutreiben.
- Die Forscherinnen und Forscher beschädigten die Software der Labormäuse, während sie sicherstellten, dass die Hardware nicht beeinträchtigt wurde. Es wurde ein beschleunigter Alterungsprozess beobachtet. Eine bahnbrechende Entdeckung!
Aber es wird noch besser:
- Außerdem setzten sie eine Gentherapie ein, um die Software der Mäuse in einen früheren, jugendlicheren Zustand zu versetzen.
- Sie wissen nicht, ob das funktioniert hat, aber es hat funktioniert, und das deutet darauf hin, dass die Zellen der Mäuse eine Sicherungskopie ihrer Software haben.
- Wenn ihre Software durch den natürlichen Alterungsprozess beschädigt wird, können wir ihre Jugendlichkeit einfach mit der Sicherungskopie der Zelle wiederherstellen.
Insgesamt sind das aufregende Neuigkeiten, denn es ist viel einfacher, unsere Software zu reparieren, als die Hardware zu reparieren oder zu ersetzen.
Glossar
Um unsere Studienzusammenfassung weiter unten optimal nutzen zu können, empfehlen wir dir, dich mit den folgenden Begriffen vertraut zu machen:
| Begriff | Erläuterung |
| Epigenetik | bezieht sich auf die Untersuchung von Veränderungen in der Genaktivität, die keine Veränderungen in der zugrunde liegenden DNA-Sequenz beinhalten. Diese Veränderungen können sich darauf auswirken, wie Gene in verschiedenen Zellen exprimiert oder ein- bzw. ausgeschaltet werden, und können durch die Umwelt, den Lebensstil und andere Faktoren einer Person beeinflusst werden. Die epigenetischen Eigenschaften sind es, die eine Zelle ausmachen, und die Aktivierung oder Deaktivierung verschiedener Gene innerhalb einer Zelle ist auch das, was eine Blutzelle von einer Nervenzelle unterscheidet. |
| Treue DNA-Reparatur | bezieht sich auf den Prozess, durch den Zellen Fehler oder Schäden am DNA-Molekül reparieren, um die Integrität des genetischen Codes zu erhalten. Treu bedeutet, dass der Reparaturprozess korrekt durchgeführt wird und keine DNA-Mutationen verursacht. |
| DNA-Mutationen | bezeichnen Veränderungen in der DNA-Sequenz, die auf natürliche Weise oder als Folge der Einwirkung bestimmter Umweltfaktoren wie Strahlung oder Chemikalien auftreten können. Einige Mutationen können genetische Störungen verursachen oder das Risiko für bestimmte Krankheiten erhöhen. |
| DNA Methylierung Uhr | ist ein biologischer Marker, der die Anhäufung von epigenetischen Veränderungen in der DNA im Laufe der Zeit widerspiegelt. Mit dieser Uhr kann das Alter einer Zelle, eines Gewebes oder eines Organismus geschätzt werden. Sie ist ein Parameter, mit dem sich unser biologisches Alter abschätzen lässt. |
| Zelluläre Identität | bezieht sich auf die Merkmale, die einen bestimmten Zelltyp definieren, wie zum Beispiel seine Form, Größe, Funktion und Genexpressionsmuster. |
| ICE (induzierbare Veränderungen im Epigenom) | bezieht sich auf den Prozess, durch den Umwelt- oder andere Faktoren Veränderungen an den epigenetischen Markierungen auf der DNA einer Person verursachen können, die die Expression bestimmter Gene beeinflussen und möglicherweise zu Krankheiten führen können. |
Hintergrund der Studie
Diese internationale Studie mit dem Titel "Loss of epigenetic information as a cause of mammalian aging" (Verlust epigenetischer Informationen als Ursache des Alterns bei Säugetieren) wurde 13 Jahre lang vorbereitet und schließlich am 12. Januar im Cell Journal veröffentlicht. Sie wurde von einem internationalen Team verfasst, zu dem auch David Sinclair gehört, ein Professor für Genetik an der Harvard Medical School, der für seine bahnbrechenden Forschungen zum Altern bekannt ist und täglich 1 Gramm NMN einnimmt. In der Veröffentlichung werden zahlreiche Experimente beschrieben, die durchgeführt wurden, um die Ursachen des Alterns auf molekularer Ebene zu ermitteln.
Welche Nahrungsergänzungsmittel nimmt Dr. Sinclair ein? Lies seine longevity
Bisherige Erkenntnisse und die RCM-Hypothese
- Forscherinnen und Forscher haben das Altern bereits mit doppelsträngigen DNA-Brüchen in Verbindung gebracht, die in etwa 10 bis 50 Zellen pro Tag auftreten.
- In letzter Zeit wurde jedoch die Frage aufgeworfen, ob DNA-Mutationen tatsächlich der Hauptgrund für das Altern sind. Mehrere Befunde deuten darauf hin, dass mehr dahinterstecken könnte.
- Es wurde festgestellt, dass verschiedene Arten älterer Zellen nur sehr wenige Mutationen aufweisen, und bei einigen Mäusen oder Menschen wurde kein vorzeitiges Altern festgestellt.
- Außerdem deuteten die Ergebnisse von Hefestudien aus dem Jahr 1997 darauf hin, dass der Verlust von epigenetischen Informationen und nicht von genetischen Informationen die Ursache für die Alterung sein könnte.
- In der Folge wurden epigenetische Veränderungen auch bei Tieren wie Fliegen, Würmern und Nacktmullen mit dem Altern in Verbindung gebracht.
Das brachte Dr. Sinclair und sein Team dazu, die "RMC (Relocalization of Chromatin Modifiers)-Hypothese" aufzustellen.
Die RCM-Hypothese geht davon aus, dass die Alterung in tierischen Zellen das Ergebnis des Verlusts epigenetischer Informationen und transkriptioneller Netzwerke im Laufe der Zeit ist. Der zugrundeliegende Mechanismus, der dies verursacht, hat sich so entwickelt, dass er unsere Reaktion auf zelluläre Schäden wie doppelsträngige DNA-Brüche (DSBs) mitreguliert.
Wie ICE die RCM-Hypothese testet
Um diese Hypothese zu testen, entwickelten die Forscher Methoden, mit denen sie die epigenetischen Informationen sowohl in vitro (in Zellen) als auch in vivo (in Mäusen) zunächst abbauen und dann zurücksetzen konnten.
Das wichtigste Experiment bestand darin, temporäre Schnitte in der DNA der Labormäuse zu erzeugen. Diese Brüche sollten die geringfügigen Brüche in den Chromosomen nachahmen, die in unseren Zellen und in den Zellen dieser Mäuse täglich im Laufe der Zeit als Reaktion auf Sonnenlicht, Chemikalien, kosmische Strahlung und andere Umweltfaktoren auftreten.
Da sie testen wollen, wie sich epigenetische Veränderungen auf das Altern auswirken, wurden diese Brüche so konzipiert, dass sie nur das Epigenom verändern, also nicht in der kodierenden Region der Mäuse-DNA vorgenommen wurden, um Genmutationen zu verhindern (d.h. nicht mutagene Schnitte)
Die neu entwickelte Methode für diese absichtlichen Chromosomenbrüche wurde das ICE-System genannt. Die Versuchspersonen bekamen den passenden Spitznamen ICE-Mäuse.
Wenn die RCM-Hypothese also stimmt, sollten diese mutagenen Schnitte die epigenetische Alterung der ICE-Mäuse beschleunigen und auch andere altersbedingte Merkmale im Vergleich zu ihren nahen Verwandten (der Kontrollgruppe, die keinen Brüchen ausgesetzt war) beschleunigen.
Was passierte, nachdem die Mäuse diese Brüche erlitten hatten?
Zunächst unterschieden sich ihr Verhalten, ihr Aktivitätsniveau und ihr Nahrungsverzehr nicht von denen der negativen Kontrollgruppe. Nachdem sie einen Bruch erlitten hatten, verlagerten die epigenetischen Faktoren einfach ihren Schwerpunkt von der Genregulierung auf die Koordination der Reparaturen der DNA-Brüche. Nachdem der Bruch repariert war, kehrten sie zu ihrer alten Aufgabe der Genregulierung zurück.
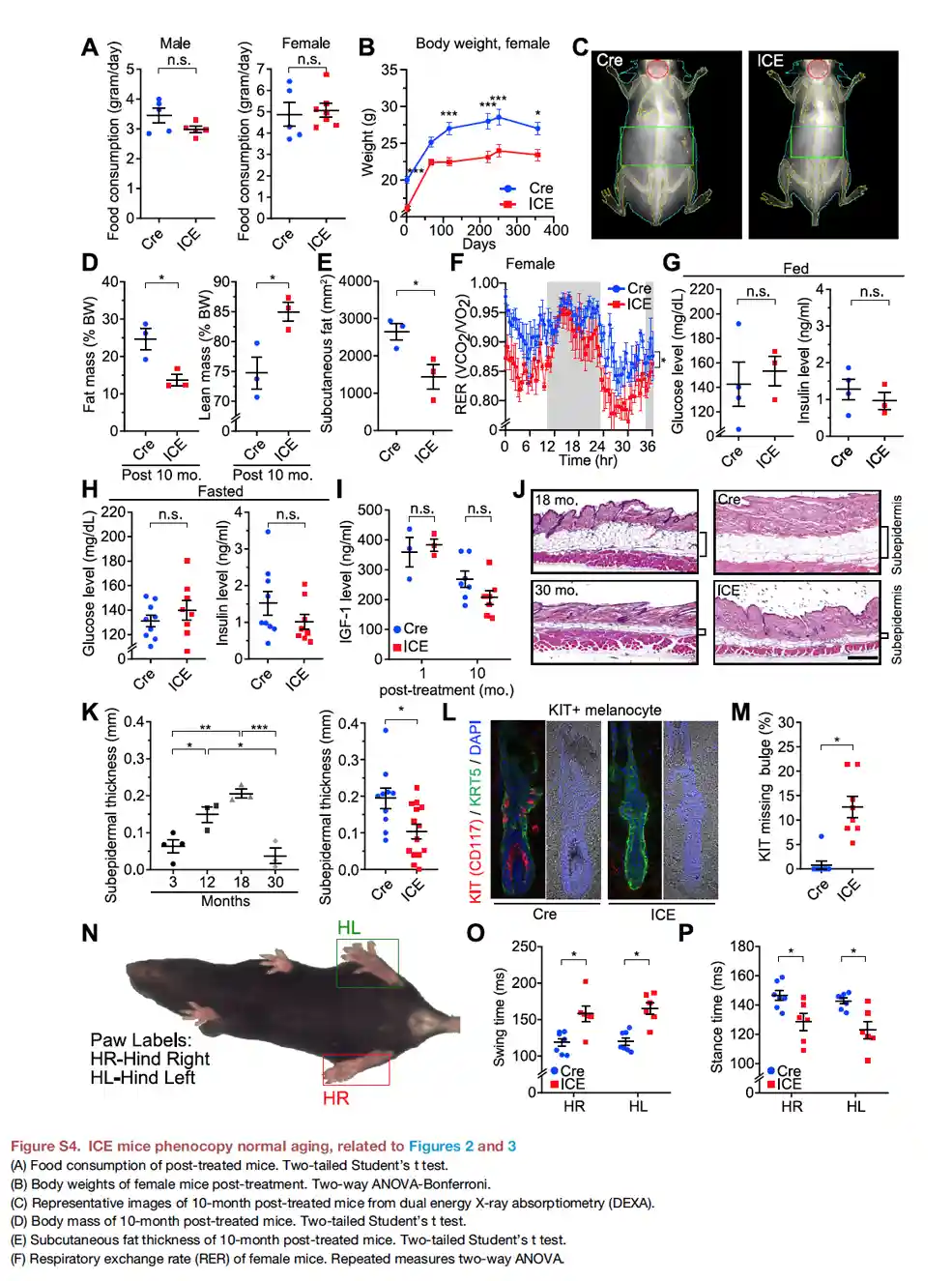
Doch nach einem Monat ICE begannen sich einige Veränderungen zu zeigen. Die ICE-Mäuse bekamen Haarausfall und verloren Pigmente an Nase, Ohren, Füßen und Schwanz. Diese physiologischen Veränderungen treten typischerweise bei Mäusen mittleren Alters auf.
Nach 10 Monaten verloren die ICE-Mäuse auch an Körpergewicht, hatten ein niedrigeres Atemaustauschverhältnis und bewegten sich in der Dunkelphase weniger. All dies sind typische Merkmale, die auf ein hohes Alter bei Mäusen hinweisen. Die Ergebnisse unter dem Mikroskop stimmten mit diesen Beobachtungen überein: Die Forscherinnen und Forscher stellten fest, dass die oben genannten epigenetischen Faktoren nach der Reparatur von DNA-Brüchen nicht zu ihrer Aufgabe zurückkehrten. Dies führte zu Chaos und Fehlfunktionen innerhalb des Epigenoms.
Wir können zwar schon ziemlich sicher sein, dass die ICE-Mäuse tatsächlich schneller gealtert sind. Die Forscherinnen und Forscher gingen noch einen Schritt weiter und nutzten ein von ihrem Labor entwickeltes Instrument, mit dem sie das biologische Alter der Mäuse messen konnten. Die DNA-Methylierungsuhr kann an Zellen, Geweben oder Organismen eingesetzt werden. Das biologische Alter der ICE-Mäuse war im Vergleich zu den unbehandelten Negativkontrollen deutlich höher.
Zusammenfassend lässt sich sagen, dass das Experiment zeigte, dass die nicht-mutagenen DNA-Brüche bei Mäusen, die DNA-Brüche im Alltag nachahmen:
- Beschleunigung des Alterungsprozesses, der sich in physiologischen Veränderungen wie Haarausfall, Pigmentverlust, geringerem Körpergewicht, geringerer Bewegung während der Dunkelphasen und einem niedrigeren RER (respiratory exchange ratio) zeigt.
- Beschleunigte Alterung nach der DNA-Methylierungsuhr, die das Alter biologisch und nicht chronologisch misst.
- Negative Auswirkungen auf die epigenetische Landschaft, wenn epigenetische Faktoren nicht zur DNA-Regulierung zurückkehren, nachdem sie die Reparatur von induzierten DNA-Brüchen reguliert haben.
Diese Ergebnisse unterstützen die Annahmen der RCM-Hypothese.
Verjüngung von ICE-Mäusen
Zu diesem Zeitpunkt konnten die Forscher jedoch noch nicht sicher sein, dass DNA-Mutationen diese Effekte nicht verursachen. Um diese Möglichkeit auszuschließen, mussten sie das Epigenom sowohl in vivo als auch in vitro zurücksetzen.
Um diese "Gentherapie" zur Wiederherstellung des Epigenoms durchzuführen, verabreichten sie drei Gene namens Oct4, Sox2 und Klf4. Das Trio wird als OSK bezeichnet. Diese Gene werden normalerweise während der Embryonalentwicklung angeschaltet und sind auch in Stammzellen vorhanden. Sie helfen reifen Zellen, in einen jugendlicheren Zustand zurückzukehren.
Wissenswertes: Im Jahr 2020 konnte Sinclairs Labor mit diesen drei Genen das Sehvermögen blinder Labormäuse wiederherstellen
Die Ergebnisse dieser Gentherapie
Das Gewebe und die Organe der ICE-Mäuse wurden erfolgreich in einen früheren, jugendlichen Zustand zurückversetzt. Wir wissen noch nicht, wie die OSK-basierte Gentherapie das erreicht, aber wir wissen nur, dass sie funktioniert. Wir wissen auch, dass zur Wiederherstellung der Daten ein Backup erforderlich ist. Da sich das Backup nicht in den OSK-Genen befinden kann, muss es sich in den Säugetierzellen der ICE-Mäuse befinden. Mit anderen Worten: In den Zellen der Mäuse steckt ein potenzieller Jungbrunnen, und wir haben einen Weg gefunden, ihn anzuzapfen!
Die Mitbringsel
Die umfangreichen Versuchsreihen des Forschers bestätigen, dass die Hauptursache des Alterns nicht in DNA-Veränderungen liegt. Stattdessen scheint das Altern durch Veränderungen in der Struktur des Chromatins, einem epigenetischen Faktor, der für die Bildung der Chromosomen verantwortlich ist, vorangetrieben zu werden.
Für Anti-Aging-Forscher sind diese neuen Erkenntnisse äußerst ermutigend und aufregend, denn die Manipulation von Molekülen, die epigenetische Faktoren kontrollieren, ist viel einfacher als die Umkehrung von DNA-Mutationen. Die Studie zeigt, dass wir das Alter von Mäusen genau kontrollieren können. Wir können es beschleunigen, verlangsamen oder umkehren, wie wir wollen.
Die Veröffentlichung zeigte außerdem, dass die Säugetierzellen von Mäusen eine Sicherheitskopie ihrer epigenetischen Informationen speichern. Mithilfe von drei Genen, die als OSK bekannt sind, wurde das Epigenom mit Hilfe dieser Sicherungskopie wieder in einen jugendlichen Zustand versetzt.
Würden ICE und OSK Gentherapie beim Menschen funktionieren?
Labormäuse haben in Bezug auf Genetik und Physiologie viele Gemeinsamkeiten mit dem Menschen. Es gibt jedoch auch bedeutende Unterschiede zwischen den beiden Spezies, die bei der Interpretation der Ergebnisse präklinischer Studien berücksichtigt werden müssen.
Ein großer Unterschied ist, dass Mäuse eine viel kürzere Lebenserwartung haben als Menschen, was die Entwicklung und den Verlauf bestimmter Krankheiten beeinflussen kann. Auch die Größe und der Aufbau bestimmter Organe, wie z. B. des Gehirns, können sich zwischen den beiden Arten unterscheiden.
Trotz dieser Unterschiede sind viele der zellulären und molekularen Prozesse, die in Mäusen ablaufen, auch beim Menschen vorhanden, was sie zu nützlichen Modellen für die Untersuchung menschlicher Krankheiten macht. Da sich Menschen und Mäuse auf zellulärer Ebene sehr ähnlich sind (beide sind Säugetierzellen), ist es wahrscheinlich, dass auch menschliche Zellen über Sicherungskopien ihres Epigenoms verfügen.
Vorwärts bewegen
Die ICE-Methode ist ein wichtiger Meilenstein für die Anti-Aging-Forschung. Künftige Experimente zum Epigenom von Mäusen werden wahrscheinlich kosten- und zeiteffizienter sein, da ICE-Mäuse bereits nach sechs Monaten statt der üblichen 1,5 bis 2 Jahre "alt" werden.
In weiteren Experimenten sollte untersucht werden, wie die OSK-Gentherapie das bemerkenswerte "Verjüngungsprogramm" bei den Mäusen hervorruft. Vielleicht können andere, effizientere Wege zur Wiederherstellung des epigenetischen Backups gefunden werden.
Die Forscherinnen und Forscher hoffen, dass diese Veröffentlichung die Wissenschaftlerinnen und Wissenschaftler nicht nur dazu inspirieren wird, mehr darüber zu erfahren, wie wir unser biologisches Alter kontrollieren können, sondern auch dazu, Krankheiten und Zustände zu verhindern, die mit dem Alter einhergehen, wie z. B. Typ-2-Diabetes, neurodegenerative Erkrankungen und Herz-Kreislauf-Erkrankungen (die Todesursache Nr. 1 in den meisten Ländern).
Eine überzeugende Studie zur NMN-Supplementierung am Menschen: Lies diese vielversprechende Studie über NMN weiter.

Verfolge 50+ Gesundheitsdaten mit KI-gestützter Genauigkeit. Starte noch heute deine kostenlose Testversion und übernimm die Kontrolle über deine Wellness-Reise!

longevity beste Übungen Ernährung Diäten gesunder Lebensstil
Die Kunst, gut zu leben - ein Leben, das nicht nur an Jahren gemessen wird, sondern an Erfahrungen, Gesundheit und Freude!












